|
Za početak definirajmo pojmove tablica i sustav. Pojam tablice
podrazumijeva dvodimenzionalnost, dakle samo dvije koordinate, a
pojam sustava podrazumijeva tri ili više koordinata. Osobina i tablice
i sustava je raspored simbola od kojih svaki vrijedi za jedan u
nizu sličnih objekata. Objekti su slični po svojstvu (ili svojstvima)
koje mjerimo ili izabiremo na jednak način iako se vrijednosti koje
dobivamo razlikuju za svaki objekt.1
Objekti modernog periodnog sustava elemenata su atomi elemenata,
a svojstva atomski parametri: redni broj, efektivni naboj, energija
ionizacije, atomski polumjeri, elektronegativnost i elektronska
konfiguracija.
Atom je građen od jezgre i odgovarajućeg broja elektrona. U kemijskim
vezama, međutim, sudjeluju samo valentni elektroni, a ostatak atoma
(jezgra i unutarnji elektroni) ostaje nepromijenjen. Taj nepromjenljivi
dio atoma dobro je zvati srž atoma (eng. atomic core).
Energija ionizacije, polumjeri i elektronegativnost ovise o sili
kojom srž atoma privlači valentne elektrone. To privlačenje ovisi
o naboju jezgre umanjenom za parametar zastiranja. Naboj jezgre
umanjen za parametar zastiranja zovemo efektivni naboj. Parametar
zastiranja ovisi o broju unutarnjih elektrona i manje o odbijanju
vanjskih elektrona međusobno.
Unutar periode efektivni naboj raste s lijeva na desno jer je parametar
zastiranja jednak, a naboj jezgre ima cjelobrojni pomak za jedan
na više. Niz grupu (skupinu) efektivni naboj opada jer broja unutarnjih
elektrona raste razmjerno više prema naboju jezgre. Uočljivo je
dakle da efektivni naboj unutar periodičke tablice elemenata raste
s lijeva na desno i odozdo prema gore. Budući da su energije ionizacije
i elektronegativnosti proporcioanlne efektivnom naboju i one slijede
isto pravilo. Atomski polumjeri pak, obrnuto su proporcionalni efektivnom
naboju.
Prema L. C. Allenu elektronegativnost je prosječna jednoelektronska
energija elektrona vanjske ljuske u osnovnom stanju slobodnih atoma.2,3,4
Dana je sljedećom jednadžbom,
c
spec = (me p
+ ne
s) /
(m
+ n)
gdje je c spec
elektronegativnost, m i n su brojevi p
i s valentnih elektrona, a e p i e s njihove energije ionizacije.
Uporabljene energije ionizacije dobivene su fotoelektronskom spektroskopijom,
a nastaju mjerenjem kinetičke energije elektrona izbačenih iz atoma
monokromatskim UV ili X zračenjem. Te vrijednosti jednake su
za sve elektrone iste podljuske. Primjerice za ugljik e s = 1,72 MJ mol- 1,
a e p = 1,09 MJ mol- 1
tako da je
c
spec = [ 2(1,72) + 2(1,09)] / (2 + 2) = 1,41 MJ mol-
1.
Za prilagođavanje ovako dobivenih vrijednosti skalama L. Paulinga
i A. Allred- E. Rochowa, prema Allenu, množimo ih s 1,82. Tako nastaje
sljedeća tablica.
Tablica 1. Elektronegativnosti elemenata.
|
H
2,3
|
He
4,2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li
0,91
|
Be
1,58
|
|
|
|
|
|
|
|
|
|
|
B
2,05
|
C
2,54
|
N
3,07
|
O
3,61
|
|
Na
0,87
|
Mg
1,29
|
|
|
|
|
|
|
|
|
|
|
Al
1,61
|
Si
1,92
|
P
2,25
|
S
2,59
|
|
K
0,73
|
Ca
1,03
|
Sc
1,3
|
Ti
1,3
|
V
1,4
|
Cr
1,5
|
Mn
1,6
|
Fe
1,7
|
Co
1,8
|
Ni
1,9
|
Cu
1,8
|
Zn
1,6
|
Ga
1,76
|
Ge
1,99
|
As
2,21
|
Se
2,42
|
|
Rb
0,71
|
Sr
0,96
|
Y
1
|
Zr
1,1
|
Nb
1,3
|
Mo
1,4
|
Te
1,5
|
Ru
1,7
|
Rh
1,8
|
Pd
1,9
|
Ag
2
|
Cd
1,5
|
In
1,66
|
Sn
1,82
|
Sb
1,98
|
Te
2,16
|
|
Cs
0,66
|
Ba
0,88
|
Lu
|
Hf
|
Ta
|
W
|
Re
|
Os
|
Ir
|
Pt
|
Au
|
Hg
1,8
|
Tl
|
Pb
|
Bi
|
Po
|
Iz tablice je vidljivo ne samo da vodik pripada prvoj grupi nego
i da helij pripada drugoj.
Do istih rezultata došao je i P. Vrkljan na temelju dijagrama prosječnih
energija ionizacije valentnih elektrona.5
Prosječne energije ionizacije dobio je zbrajanjem sukcesivnih energija
ionizacije dobivenih iz emisijskih linijskih spektara. Njihove vrijednosti
nisu jednake za elektrone iste podljuske. Zbroj energija
ionizacije podijeljen s njihovim brojem daje prosječnu energiju
ionizacije. Posljedak je sljedeći dijagram:
Tablica 2. Prosječne energije ionizacije
valentnih elektrona dane u kJ mol- 1
|
Grupa
>
|
I
|
II
|
|
III
|
IV
|
V
|
VI
|
VII
|
|
Perioda
|
|
|
|
|
|
|
|
|
|
1.
|
1312
|
3811
|
|
|
|
|
|
|
|
2.
|
513
|
1328
|
|
2296
|
3570
|
5150
|
6965
|
9081
|
|
3.
|
496
|
1094
|
|
1713
|
2488
|
3411
|
4447
|
5636
|
|
4.
|
418
|
867
|
d-
blok
|
1840
|
2503
|
3272
|
4095
|
5079
|
|
5.
|
403
|
807
|
|
1694
|
2248
|
2946
|
3577
|
4465
|
|
6.
|
376
|
734
|
|
1813
|
2332
|
2910
|
3652
|
4376
|
|
7.
|
400
|
744
|
|
|
|
|
|
|
Sada je sasvim jasno da vodik pripada prvoj grupi, a helij drugoj.
Uočite da je energija ionizacije prvog člana skupine bitno veća
od energija ionizacije ostalih članova čije se energije postupno
smanjuju. Prividne anomalije u trećoj i četvrtoj grupi i kongenerima
u višim periodama posljedica su specifičnih karakteristika elektronskih
struktura.
Poradi utvrđivanja pripadnosti elektrona istoj ljusci ili podljusci
potrebno je drugu energiju ionizacije podijeliti s dva, treću s
tri, četvrtu s četiri itd., i uporediti. Oni elektroni koji pripadaju
istom energijskom nivou imaju približno jednake tako izračunate
vrijednosti.7 Primjerice energije ionizacije,
u eV, za Al su: I1 = 6,0, I2
= 18,8, I3 = 28,5, I4
= 120,0 itd. Slijedi I1 / 1 = 6,0,
I2 /2 = 9,4, I3
/3 = 9,5, I4 /4 = 30,0 itd. Iz
prve tri vrijednosti slijedi da su odgovarajući elektroni u istoj
ljusci i to jedan u p podljusci, a druga dva u s podljusci.
Predlažemo sljedeću periodičku tablicu
.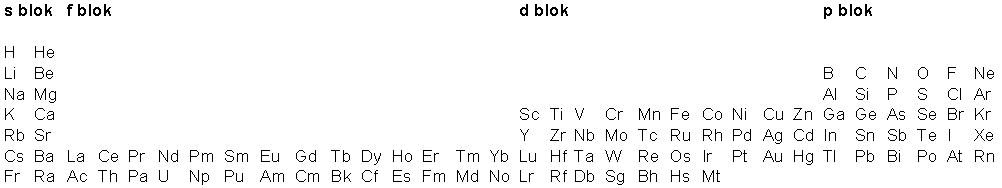
Simboli Rf, Db, Sg, Bh, Hs i Mt uzeti su po preporuci IUPAC- a
za elemente rednih brojeva od 101 do 109. Delegati iz 40 zemalja
prihvatili su glasovanjem (64 : 5, 12 suzdržanih) izvješće CNIC-
a (zainteresirani mogu pronaći više informacija na adresi http://
jchemed.chem.wisc.edu /).8
Literaturna vrela
- Hefferlin C
Periodic Systems and their relation to the systematic analyses
of molecular data,
chap. 15, p. 556, Edwin Mellen Press, Ontario,
1989.
- Allen LC
J Am Chem Soc
111 (1989) 9003 - 9014.
- Mulliken RS
J Chem Phys
2 (1934) 782 - 793.
- Pauling LC
J Am Chem Soc
54 (1932) 3570 - 3582.
- Vrkljan P
Najbolji oblik periodne tablice,
XIV. Skup hrvatskih kemičara, Zbornik
sinopsisa, I- 413, Zagreb, 1995.
- Emsley J
The Elements,
Oxford University Press, 1989.
- Pimentel G
Understanding Chemistry,
chap. 13, Holden- Day, San Francisco, 1971.
- J Chem Ed
74(11) (1997) 1258.
|