 |
 |
Tankoslojna kromatografija ß-diketonata Fe(III) i Cu(II) iona
|
 |
|
|
11.11.2002.
|
 |
|
|
 |
 |
SAŽETAK
Istraživani su pogodni uvjeti za tankoslojno kromatografiranje acetilacetonata i dibenzoilmetanata Fe(III) i Cu(II) iona. Kao stacionarne faze uporabljeni su aluminijev oksid, celuloza, poliamid i silikagel, a kao mobilne aceton, benzen, kloroform, metanol, tetraklorougljik i njihove odgovarajuće smjese. Detekcija uzoraka izvršena je jodom. Svi kromatogrami izvedni su dvaput. Sveukupno je načinjeno 69 kromatograma na temelju kojih je odabrano 6 pogodnih kombinacija stacionarnih i mobilnih faza.
1. UVOD
Dosada je provedeno relativno malo sustavnih istraživanja1 u cilju iznalaženja uvjeta identifikacije, izolacije i odvajanja acetilacetonata i dibenzoilmetanata Fe(III) i Cu(II) iona tankoslojnom kromatografijom.
ß-diketonati Fe(III) i Cu(II) iona, kao i drugi spojevi ove vrste, su spojevi široke primjene, a koriste se u katalitičkim i ekstrakcijskim procesima, plinskoj kromatografiji, stvaranju tankih filmova, laserskoj tehnici te dobivanju koordinacijskih polimera posebnih elastičnih, električnih i/ili magnetskih svojstava.2 Njihova široka primjena u temeljnim i primjenjenim istraživanjima zahtijeva poznavanje uvjeta identifikacije i izdvajanja iz smjesa tvari.
Za proučavanje uvjeta izdvajanja pogodno je koristiti kromatografske tehnike jer omogućuju rad s malim količnima uzorka i postižu dobre rezultate. Kromatografija na tankom sloju jedna je od pogodnijih, zbog svoje relativno jednostavne i brze izvedbe.3,4
Nastajanje ß-diketonatnog kompleksa moguće je, u okviru Lewisove teorije kiselina i baza, shvatiti kao reakciju neutralizacije. ß-diketonatni anioni, Lewisove baze, reagiraju s ionima metala, Lewisovim kiselinama, te tako nastaju kompleksne jedinke opće formule MLn. Sastav novonastale jedinke ovisi o stehiometrijskom odnosu množina iona metala i ligandnih jedinki uporabljenih u sintezi, veličini i naboju iona metala te donorskim i strukturnim (prostornim) svojstvima liganada.
Za stvaranje ketoenolatnih aniona uobičajeno je u sintezama koristiti bazične jedinke, poput trietilamina, koje dehidroniraju ketoenolne molekule ß-diketona i tako stvaraju ketoenolatne ligande. Tako nastale ligandne jedinke će s Cu(II) ionima stvarati planarne, a s Fe(III) ionima oktaedarske kelatne komplekse (Slika 1.).2,5,6
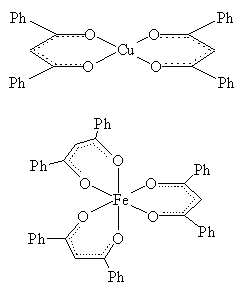
Slika 1. Kemijski dijagrami planarnih i oktaedarskih ß-diketonatnih kompleksnih jedinki.
Cilj ovog rada bio je iznaći uvjete kromatografskog pročišćavanja i međusobnog odjeljivanja acetilacetonata i dibenzoilmetanata Cu(II) i Fe(II) iona te ispitati mogući utjecaj stereokemije kompleksnih jedinki na njihova kromatografska svojstva.
2. EKSPERIMENTALNI DIO
2.1. MATERIJAL
Za pripravu uzoraka korišteni su željezov(III) klorid heksahidrat [FeCl3(H2O)6], bakrov(II) acetat monohidrat [Cu(CH3COO)2(H2O)], acetilaceton (C5H8O2), dibenzoilmetan (C15H12O2), etanol (C2H5OH) i trietilamin [N(C2H5)3].
Stacionarne faze bile su sljedeće kromatografske pločice: aluminijev oksid 60 F254 neutralni (tip E), celuloza F, poliamid 11 F254, silikagel 60 F254. Sve pločice su proizvodi tvrtke MERCK. Kao mobilne faze korišteni su aceton, benzen, kloroform, metanol i tetraklorougljik. Stupanj čistoće svih otapala bio je p. a. i ona nisu dodatno pročišćavana.
Kao kromatografske komore uporabljivane su obične staklenke (marmelada, kiseli krastavci...) volumena 720 cm3 koje su iznutra obložene filtar papirom i zatvorene originalnim poklopcem. Uzorci su nanošeni na sloj kapilarom vanjskog promjera 1,4, a unutarnjeg 0,6 mm.
2.2. METODE
2.2.1. PRIPRAVA UZORAKA
Svi kompleksni spojevi priređeni su na već opisan način6, s tim da je unaprijed određena masa liganda od 0,5000 g.
2.2.2. OPĆI OPIS IZVEDBE TANKOSLOJNE KROMATOGRAFIJE
U kromatografsku komoru dodano je 20 cm3 otapala. U slučaju smjesa otapala dodano je 20 cm3 tekuće smjese, u kojoj je svako otapalo bilo u određenom volumnom udjelu. Komora je iznutra obložena filtar papirom kako bi se postigla što bolja zasićenost atmosfere u komori parama otapala. Svi kromatografski postupci izvođeni su pri sobnoj temperaturi.
Sve kromatografske pločice bile su istih dimenzija (5 cm ? 10 cm), a duljina fronte otapala iznosila je 8,0 cm. Udaljenost početne linije od ruba pločice bila je 1,0 cm, a otapalo nikad nije odmah po postavljanju pločice u komoru dodirivalo početnu liniju.
Uzorci su otopljeni u etanolu (c ? 0,1 mol L-1) i na tanki sloj nanošeni kapilarom. Prije unošenja u komoru pločice su osušene na zraku. Na jednu su pločicu nanošena istovremeno četiri različita uzorka. Na kraju razvijanja pločice su izvađene iz komore i osušene na zraku. Ukupno je izvedeno 69 kromatograma u tri serije. Na temelju prikupljenih kromatografskih rezlutata odabrane su konačne kombinacije stacionarnih i mobilnih faza za pojednine uzorke. Kao dobri kromatogrami odabrani su oni s dobro definiranim točkama položaja spojeva, umjerenim Rf vrijednostima. Nekoliko takvih prikazano je na Slici 2.

Slika 2. Fotografija kvalitetnih kromatograma željezovih(III) i bakrovih(II) acetilacetonata i dibenzoilmetanata raspoređenih na pojedinom kromatogramu kao u Tablici 1.. Gledano s lijeva na desno, stacionarna faza prvog kromatograma je aluminijev oksid, a mobilna metanol, stacionarna faza drugog i trećeg kromatograma je silikagel, a mobilne faze su, redom, benzen i kloroform. (Snimio gosp. M. Brozović.)
2.3. REZULTATI
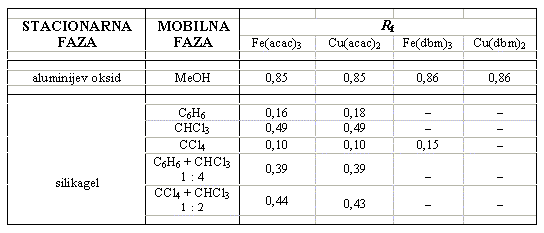
U Tablici 1. dan je pregled Rf vrijednosti. Detekcija dibenzoilmetanatnih kompleksa na silikagelnim kromatogramima nije bila uspješna što može biti povezano s raspadom uzorka.
Tablica 1. Rf vrijednosti za pojedine uzorke uz konačne kombinacije odgovarajućih stacionarnih i mobilnih faza. Vrijednosti su srednje vrijednosti dva ili tri mjerenja.
3. RASPRAVA
U većini slučajeva Rf vrijednosti kompleksnih spojeva, bilo Fe(III) ili Cu(II) iona, s istim ligandom međusobno su jednake. Rezultati dobiveni s određenim stacionarnim i mobilnim fazama upućuju na mogućnost razlikovanja i odvajanja acetilacetonatnih od dibenzoilmetanatnih kompleksa. Za pretpostaviti je da ovakva svojstva spojeva određuju terminalni ogranci ß-diketonatnih liganada te da stereokemija kompleksnih molekula nema presudan utjecaj na njihovu međusobnu razlučivost. Nastavak istraživanja usmjeren je na ovu problematiku.
4. LITERATURA
1. R. J. Clark i C. S. Williams, Inorg. Chem. 4(3) (1965) 350 - 354.
2. J. P. Collman, R. P. Blair, R. L. Marshall i L. Slade, Inorg. Chem. 2(3) (1963) 576 - 582.
3. R. Stock i C. B. F. Rice, Chromatographic Methods, Chapman and Hall, Great Britain, 1967.
4. S. Turina, Tankoslojna kromatografija, SKTH/Kemija u industriji, Zagreb, 1984., 5 - 55.
5. N. Judaš, Magistarska teza, Centralna kemijska biblioteka, Prirodoslovno-matematički fakultet, Sveučilište u Zagrebu, Zagreb, 1999., 1 - 14.
6. Ž. Đukanović, Diplomska radnja, Knjižnica Zavoda za opću i anorgansku kemiju, Prirodoslovno-matematički fakultet, Sveučilište u Zagrebu, Zagreb, 1998., 2 - 9.
7. D. Grdenić, Molekule i kristali, Školska knjiga, Zagreb, 1989., 256 - 273.
REALIZIRANO: 2000. |
|
|
|

