 |
DSNK_2001_2 zadaci
1. Zaokruži slova ispred neispravne tvrdnje:
A) Kalorimetar je uređaj za mjerenje boje apsorbirane
svjetlosti.
B) Molarni toplinski kapacitet je količina topline koju je potrebno dovest uzorku od jednog mola tvari da bi se temperatura tog uzorka povisila za 1 K.
C) Standardna temperatura pri termokemijskim mjerenjima
je 273,15 K.
D) Drugi zakon termodinamike kaže: Pri apsolutnoj nuli entropija savršeno sređene kristalne tvari je nula.
E) Entalpija, entropija i Gibbsova energija su funkcije stanja.
2. Plinska smjesa sačinjena od 1 L nepoznatog plina i 2 L kisika dovedena je do eksplozije. U reakciji su nastale 2 L ugljikovog(IV) oksida i 1 L dušika, mjereno pri istim uvjetima. Napiši molekulsku formulu nepoznatog plina.
Molekulska formula je______________.
3. U sljedećoj tablici za svaku kombinaciju promjene entalpije i promjene entropije u retcima, (stupci 1 i 2) zaokruži ispravne odgovore vezane za promjenu Gibbsove energije i spontanost procesa (stupci 3 - 6):

4. Za taljenje 1 g leda utroši se 334 J. Izračunaj molarnu entapiju taljenja leda u kJ/mol.
Koliko energije (u kJ) treba utrošiti da se 100 g leda od
0 °C prevede u vodenu paru pri 100 °C i stalnom tlaku od 101 325 Pa? Specifična entalpija isparavanja vode je 2 255 J/g. Specifični toplinski kapacitet tekuće vode je 4 187 J K-1 kg-1.
5. Zaokruži slovo ispred neispravne tvrdnje:
A) Gustoća je intenzivno svojstvo tvari (ne ovisi o masi i volumenu uzorka).
B) Viskoznost je to veća što su molekule polarnije ili su duže i razgranatije.
C) Areometar je uređaj za mjerenje površine uzorka.
D) Napetost površine žive je pri sobnoj temperaturi manja od napetosti površine vode.
E) Stalagmometrom se mjeri duljina stalagmita u podzemnim špiljama.
F) Tenzidi su tvari koje jako smajuju napetost površine.
6. a) Na temelju zadanih podataka nacrtaj dijagram topljivosti navedenih spojeva.
Topljivosti su dane kao mase soli koje je moguće otopiti u 100 grama vode pri odgovarajućoj temperaturi.
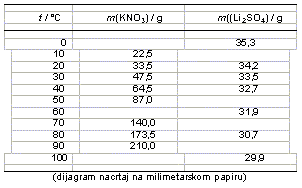
b) Pri kojoj temperaturi su topljivosti soli jednake?
Topljivosti su jednake pri ___________.
c) Kako biste izdvojili čisti litijev sulfat iz smjese s kalijevim nitratom? Sastav smjese je 42 grama litijevog sulfata i 42 grama kalijevog nitrata.
7. Izračunaj volumen otopine klorovodične kiseline (w = 36 %, ρ = 1,18 g/cm3) koji treba otpipetirati za pripremu 500 mL otopine množinske koncentracije 0,2 mol/L.
8. Zaokruži slova ispred točnih tvrdnji.
A) Solovi su disperzni sustavi u kojima je disperzna faza čvrsta tvar a disperzno sredstv tekućina.
B) Tyndallov efekt je pojava raspršivanja svjetlosti u otopinama na česticama manjim od 1 nm.
C) Emulzije su koloidni sustavi dviju tekućina koje se ne miješaju.
D) Koloidne sustave čine čestice disperzne faze veće od 200 nm raspršene u disperznom sredstvu.
E) Osmoza je pojava prodiranja otapala kroz za otapalo propusnu a za otopljenu tvar nepropusnu membranu iz otopine veće koncentracije otapala u otopinu manje koncentracije otapala.
F) Elektroforeza je pojava gibanja nabijenih koloidnih čestica u nepokretnoj tekućini uslijed djelovanja električnog polja.
9. Kolika je masena koncentracija dušične kiseline ako je njezin maseni udio 33 % a gustoća 1,2 g/cm3?
10. Na brzinu kemijske reakcije ne utječe:
A) koncentracija
B) katalizator
C) površinska napetost
D) temperatura
E) inhibitor
F) magnetska svojstva reaktanata
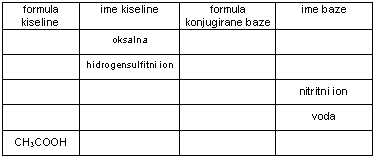
11. Popuni u tablici nepopunjena polja.
12. Izjednači jednadžbu kemijske reakcije
ion-elektron metodom (parcijalnim jednadžbama).
S + HNO3 → H2SO4 + NO2 + H2O
13. pH otopine neke slabe kiseline u vodi je 2,75. Ako je početna koncentracija te kiseline 0,2 mol/L izračunaj konstantu disocijacije te kiseline.
14. Za sljedeća dva redoks-sustava
H2O2 + 2 H+ + 2 e- → 2 H2O
E° = 1,77 V
Br2 + 2 e- → 2 Br-
E° = 1,07 V
odgovori:
a) Koja je molekula ili ion u navedenim sustavima najjači oksidans?
b) Koja je molekula ili ion u navedenim sustavima najjači reducens?
c) Svaki oksidans se _____________, a svaki reducens se ____________________.
d) Što je standardni redukcijski potencijal nekog redoks-sustava pozitivniji to je njegov oksidirani oblik jači _________________.
e) Što je standardni redukcijski potencijal nekog redoks-sustava negativniji to je njegov reducirani oblik jači _________________.
f) Sumarna reakcija koja će se odvijati kada se pomiješaju ova dva redoks-sustava je ______________________.
|

