Nastanak prezasićene otopine kalcijeva karbonata
Porijeklo CO2
U atmosferi
sadržaj ugljikova dioksida ponešto fluktuira, ali normalno je oko
0,3 , tj. približno 32 Pa (pri 25 °C). Uz takav parcijalni
tlak topljivost kalcita u vodi sa 14 poveća se na 55 mg/L.
Proračuni pokazuju da bi erozija tla uzrokovana otapanjem vapnenca
u vodi zasićenoj sa CO2 iz atmosfere iznosila tek jednu
desetinu stvarne, a prirodne vode sadrže mnogo više CaCO3:
između 10 i 300 mg/L (obično 50 90 mg/L).
Uzrok
povećanoj moći otapanja prirodne vode je parcijalni tlak CO2
koji vlada u njoj, a veći je (u podzemnoj vodi) 10 do 100 puta od
atmosferskog tlaka CO2. Takav se tlak ne može postići
otapanjem CO2 iz atmosfere, a ne može biti ni posljedica
kemijskih reakcija u dubljim dijelovima Zemljinoj kori kojima bi
nastajao CO2 jer su visoki parcijalni tlakovi ugljikovog
doksida primjećeni i u meteorskoj vodi koja se tek procijedila kroz
tlo.
Praktički
sav otopljeni CO2 u podzemnim vodama organskog je porijekla.
Jedan dio potječe iz korijenja biljaka koje, osim kao produkt metabolizma,
ispuštaju i neiskorišteni CO2 apsorbiran za potrebe sinteze
ugljikohidrata fotosintezom (oko 40 % apsorbiranog CO2
odlazi nazad u atmosferu). Drugi izvor ugljikovog dioksida su flora
(bakterije, gljive) i fauna u tlu. Bez obzira na to čini se da glavna
produkcija potječe od transpiracije korijenja..
Optimalna
temperatura za razvoj živog svijeta u tlu je između 20 i 65°C (Miotke,
1974) iako se on odvija i pri 5°C. Proizvodnja CO2 proporcionalna
je aktivnosti organizama, stoga i temperaturi. Drugi važni faktor
je vlaga. Miotke (1974) mjerio je količinu CO2
u tlima u Njemačkoj i ustanovio da je, u sezoni rasta, u suhom tlu
parcijalni tlak 0,003 bar a u vlažnom čak 0,04 bar. Za pojedine
klimatske pojaseve uobičajeni tlakovi CO2 su (u barima):
tropi: 0,002 0,11 umjereni pojas: 0,001 0,035, tundra (ljeti):
0,002 0,01. U svakom slučaju radi se o velikom povećanju koncentracije
CO2 u odnosu na atmosfersku.
Iako
količina CO2 u tlu pokazuje velike sezonske promjene
(razmjerno temperaturi), to se manje odražava na koncentraciju karbonatne
kiseline u vodi i korozivna svojstva takve vode. Sniženjem temperature
topljivosti ugljikova dioksida i kalcijeva karbonata rastu što donekle
kompenzira posljedice manje aktivnosti organizama.
Otapanje
karbonata
CO2
koji se otopi u vodi može s njom reagirati dajući karbonatnu kiselinu
uz pripadnu konstantu ravnoteže:
|
CO2 + H2O  H2CO3
H2CO3
|
 |
a
ona disocira u dva stupnja:
|
H2CO3
 H+ + HCO3-
H+ + HCO3-
|
 |
|
HCO3-
 H+ + CO32-
H+ + CO32-
|
 |
Osim
ovih ravnoteža, prisutnih u svim prirodnim vodama izloženih atmosferi,
postoji i ravnoteža između kalcijeva karbonata u krutoj fazi i hidratiziranih
iona:
CaCO3
 Ca2+
+ CO32- Ca2+
+ CO32- |
 |
CO2
povećava topljivost kalcijeva karbonata jer nastaje mnogo topljiviji
hidrogenkarbonat. Otapanje kalcijeva karbonata, recimo vapnenca,
može se prikazati slijedećim trima jednadžbama (Plummer et al.,1978):
Ca2+
+ CO32- + H+  Ca2+ + HCO3-
Ca2+ + HCO3-
CaCO3
+ H2CO3-  Ca2+
+ 2 HCO3- Ca2+
+ 2 HCO3-
CaCO3
+ H2O-  Ca2+
+ HCO3- + OH- Ca2+
+ HCO3- + OH-
Ili
sumarno:
CaCO3
+ CO2 + H2O  Ca2+ + 2 HCO3- Ca2+ + 2 HCO3-
Dolomit
disocira na kalcijeve i magnezijeve ione pa je sumarna jednadžba
otapanja:
CaMg(CO3)2
+ 2 CO2 + 2 H2O  Ca2+ + Mg2+ + 4 HCO3- Ca2+ + Mg2+ + 4 HCO3-
U
oba slučaja dovoljno je kao anionske produkte uzeti samo hidrogenkarbonat
jer je pri vrijednostima pH u većini prirodnih voda (6,5 8,9)
količina CO32- zanemariva.
Prirodna
voda s obzirom na količinu otopljenog kalcijeva karbonata može imati
sve stupnjeve zasićenja od gotovo potpuno čiste vode (kišnica) do
velikog prezasićenja. Prikladna mjera za izražavanje stanja otopine
je stupanj zasićenosti Izas (ISAT,
SR, -), broj koji pokazuje koliko puta u vodi
ima više otopljenog CaCO3, nego što bi ga se nalazilo
da je otopina u ravnoteži s krutom fazom pri istim uvjetima (temperatura,
tlak CO2, ionska jakost
), odnosno omjer:

Na
isti načina izražava se stupanj zasićenosti prema aragonitu (samo
se Kkal zamjeni sa Karag). Međutim,
određivanje karbonatnog iona je otežano pa se stupanj zasićenosti
računa kao
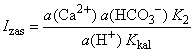
Stupanj
zasićenosti nezasićenih otopina je između 0 i 1, zasićenih 1, a
prezasićenih veći od 1. U engleskoj literaturi koristi se često
oznaka SI (engl. saturation indeks), a odnosi se i
na stupanj zasićenosti i njegov dekadski logaritam.
Drugi
važan pokazatelj stanja prirodne karbonatne vode je parcijalni tlak
ugljikovog dioksida, tj. tlak CO2 s kojim bi ta otopina
bila u ravnoteži:
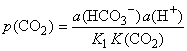
Vrlo
rijetko se može napraviti aproksimacija i u izrazima za Izas
i p(CO2) zamijeniti aktivitete pravim koncentracijama,
a da se ne učini veća pogreška u proračunima. Glavni su razlozi
stvaranje ionskih parova i utjecaj zajedničkih i stranih iona.
Važniji
ionski parovi predstavljaju kombinacije iona Ca2+, Mg2+,
K+, Na+, H+, CO32-,
HCO3-, OH- i SO42-.
Sudjelovanje ostalih iona u ionskim parovima, čak i ako se nalaze
u većim koncentracijama, kao na primjer klorid u moru, je zanemarivo.
Općenito, ne smije se zanemariti ionske parove već kod koncentracija
otopljenih tvari 150 mg/L.
Zajednički
ioni, odnosno Ca2+ i CO32-,
iz drugih minerala koji ih sadrže smanjuju topljivost CaCO3
(efekt zajedničkog iona). Glavni kalcijevi minerali koje voda otapa
putujući kroz tlo su gips, anhidrit i kalcijevi feldspati. Drugi
karbonati, osim kalcita i dolomita, su rijetki i stoga utjecaj na
topljivost kalcita ima samo dolomit, ali taj efekt nije jače izražen
(uz p(CO2)=10-3 bar litra vode
otapa 100 mg kalcita i 90 mg dolomita).
|
Tablica 1.
Topljivost nekih minerala njihova i koncentracija u slatkoj
vodi pri pH 7, tempreaturi 25 °C i tlaku 1 bar.
(Ford i Williams, 1989)
|
|
Mineral
|
Topljivost
/ mg l-1
|
Uobičajena
koncentracija u slatkoj vodi / mg l-1
|
|
Gibsit
(Al2O3 - 2H2O)
|
0,001
|
u tragovima
|
|
Kremen
(SiO2)
|
12
|
1 12
|
|
Amorfni
SiO2
|
120
|
1 65
|
|
Kalcit (CaCO3)
|
100*,500**
|
10 300
|
|
Dolomit
(CaMg(CO3)2)
|
90*,480**
|
10 300 (kao CaCO3)
|
|
Gips
(CaSO4 - 2H2O)
|
2 400
|
0 1500
|
|
Silvin
(KCl)
|
264 000
|
0 10 000
|
|
Mirabilit
(Na2SO4 - 10H2O)
|
280 000
|
5 10 000
|
|
Halit
(NaCl)
|
360
000
|
5 10 000
|
|
* p(CO2)=10-3 bar
** p(CO2)=10-1 bar
|
|
|
|
Ionska
jakost otopine posebno dolazi do izražaja u morskoj vodi, ali i
kopnena voda može sadržavati mnogo iona. Strani ioni smanjuju aktivitet
iona koji postoje u otopini kalcijeva karbonata i time povećavaju
njegovu topljivost. Zanimljivo je da Mg2+ u manjim koncentracijama
(do 10 %) smanjuje topljivost kalcita, a tek s većim koncentracijama
efekt smanjenja aktiviteta postaje dovoljno velik i topljivost raste.
Za
potrebe hidrogeokemije razvijeno je više računalnih programa koji
na temelju koncentracija otopljenih tvari, vodljivosti, pH te baze
podataka o svojstvima minerala, otopljenih čestica i ravnoteža koje
postoje u sustavu izračunavaju karakteristike otopine (npr. p(CO2),
Izas). Najpoznatiji takav program je WATEQ, napisan
još 1973. (Truesdall i Jones), a postoji i nekoliko kasnijih
verzija (WATEQF, Plummer et al., 1976; WATEQ2, Ball et
al., 1979).
S
obzirom na koncentraciju u kojoj uječu na topljivost kalcijeva karbonata,
tvari otopljene u prirodnim vodama mogu se podijeliti u dvije skupine.
Soli koje se mogu naći otopljene u većoj količini djeluju putem
povećanja ionske jakosti ili efektom zajedničkog iona. Potrebne
su velike koncentracije tih tvari da bi njihovom prisutnošću došlo
do zamjetnih promjena. Te se soli, odnosno njihovi kationi i anioni
(npr. Na+, K+, Mg2+, SO42-,
Cl-) određuju pri standardnim analizama.
Nasuprot
njima ima tvari koje i u malim količinama imaju velik učinak, a
određivanje u vodi je teško upravo zbog malih koncentracija ili
nije uobičajeno (u slučaju da se ne očekuje prisutnost tih spojeva).
Organski spojevi spadaju u ovu skupinu. U čistoj vodi ih ima relativno
malo, ali poslije jakih oborina sadržaj u podzemnoj vodi može znatno
narasti, kao i antropogenim onečišćenjem. Mnogi od tih spojeva imaju
kisele skupine i njihovom disocijacijom može se otopiti dodatna
količina karbonata budući da potiskuju disocijaciju hidrogenkarbonata.
Na ovaj način djeluju jače kiseline poput mravlje, octene, oksalne
i jabučne. Djelovanje organskih kiselina ne očituje se samo u sniženju
pH, već i kroz kompleksiranje kalcijevih iona. Također, one mogu
biti adsorbirane na površinu kristala kalcijeva karbonata. Time
ne remete ravnotežno stanje u otopini, ali mjenjaju kinetiku, kako
solvatacije, tako i precipitacije CaCO3.
Ioni
teških metala, fosfati i neke druge tvari pokazuju sličan efekt.
Budući da ovakvi mehanizmi djelovanja imaju utjecaja i na precipitaciju,
o organskim kiselinama, fosfatima i solima metala u prirodnoj karbonatnoj
vodi bit će više govora u poglavlju 4.1. gdje će se detaljnije obrađivati
kristalizacija kalcijeva karbonata.
Zasićivanje
karbonatne vode
Vjerovatno
niti o jednom problemu iz kemije prirodnih karbonatnih voda nije
toliko pisano i nije vođeno toliko rasprava koliko o mehanizmu prezasićivanja
s obzirom na kalcijev karbonat. Jedino o čemu se svi znanstvenici
koji su ih proučavali slažu je da do prezasićenja dolazi prvenstveno
uklanjanjem ugljikova dioksida iz vodene otopine CaCO3.
Time se narušava ravnoteže hidrogenkarbonat-karbonat u pravcu nastajanja
karbonata,
2
HCO3-  CO32- + CO2 + H2O CO32- + CO2 + H2O
raste
produkt aktiviteta iona CO32- i Ca2+,
a s njime i stupanj zasićenosti Izas.
Voda
iz malog broja izvora ima dovoljnu temperaturu da isparavanje vode
bude značajniji čimbenik u povećanju koncentracije otopljenih tvari.
Isparavanje u većoj mjeri odvija se djelovanjem sunca u plitkoj
zatvorenoj vodi, na primjer u malim morskim ili jezerskim zatonima,
lokvama koje nastaju oko slapova u području prskanja vode ili oko
malih izvora.
Povišena
temperatura ponajprije povećava brzinu svih reakcija koje se odvijaju
u otopini pa tako i desolvataciju CO2. Ako nije riječ
o vrućim, geotermalnim izvorima, temperatura vode funkcija je temperature
okoliša. Postoji veza između prosječne mjesečne temperature i stupnja
zasićenosti. U toku ljetnih i jesenskih mjeseci općenito je zasićenost
veća nego zimi i u proljeće (npr. Lorah i Herman, 1988; Srdoč
et al., 1985; itd). U predjelima s hladnijom klimom može prezasićenost
trajati samo u toplim mjesecima, dok zimi vlada nezasićenost koja
nije samo posljedica manje desolvatacije CO2, nego i
povećane topljivosti CaCO3 u hladnoj vodi.
Količina
CO2 u vodi, kao i fluktuacije u njegovoj koncentraciji,
mogu se odrediti i pratiti preko vrijednosti pH. Otopljeni CO2
stvara karbonatnu kiselinu koja disocira i povećava koncentraciju
vodikovih iona. Voda sa mnogo ugljikova dioksda ima niski pH, između
6 i 7. Izlaženjem CO2 pH raste, a, kad hidroliza karbonatnih
iona nadmaši disocijaciju preostalog CO2, otopina postaje
lužnata. Paralelno sa pH povećava se zasićenost.
Brzina
isplinjavanja CO2 i s njom povezano prezasićivanje kalcijevim
karbo-natom ovisi o vrlo mnogo faktora koje je teško identificirati
i odrediti njihov značaj u konkretnoj situaciji u prirodi. Čini
se da udio pojedinih od tih faktora u ukupnom učinku toliko varira
da su u pojedinim slučajevima potpuno različiti dominantni. Rezultati
eksperimenata su nesigurni jer je vrlo teško uzeti u obzir sve varijable
koje u prirodi postoje količinu vode po površini u kojoj su voda
i atmosfera u kontaktu, brzinu toka tekućica, temperaturu, tlak
CO2 u atmosferi, utjecaj živih organizama putem disanja
i fotosinteze, isparavanje vode i dr. Ista situacija je i sa mehanizmima
inicijacije precipitacije, no o tome kasnije.
U
tumačenju nastanka supersaturacije hidrogeokemičari se obično opredjeljuju
za jednu od dvije glavne struje. Dok jedni tvrde da prevladavaju
fizičko-kemijski procesi, po drugima su dominantni biokemijski.
Fizičko-kemijsko
uklanjanje CO2 odvija se dehidratacijom i izlažanjem
plina iz vode preko njene površine. Ovim procesima pogoduju evaporacija,
povišena temperatura i bilo kakva mehanička pobuda vode koja joj
povećava dodirnu površinu s atmosferom. Na vodopadima razbijanjem
vode u kapljice površina mnogostruko naraste i tu se često opaža
nagli pad količine otopljenog CO2 i s povišenim zasićenjem
povezana precipitacija (Jacobson i Usdowski, 1975; Usdowski
et al., 1979; Dandurand et al., 1982; Herman i Lorah,
1988).
Ulogu
biljaka naglašavali su na primjer Emig (1917), Pevalek
(1924, 1935, 1958), Mathews (1962). Kasnije se ustanovilo
da apsorpcija CO2, kao indirektna posljedice fotosintetske
aktivnosti putem apsorpcije CO2, ne može toliko djelotvorna
da objasni prezasićenja u nekim slučajevima u prirodi, posebno u
tekućicama. U jezerima je i dalje vodenoj flori pripisivana primarna
uloga (Stumm, 1985), ali u ostalim vodama sporedna (Spiro
i Pentecost, 1991).
Otplinjavanjem
vode fizičko-kemijskim putem prezasićivanje se odvija, osim u rijetkim
slučajevima, u cijelom volumenu vode. Stoga se analizom može utvrditi
u kojoj mjeri je došlo do promjena u kemijskom sastavu vode. Sa
promjenama uzrokovanim djelovanjem živih organizama, odnosno biokemijski,
nije tako. Cijanobakterije i zelene biljke koje apsorbiraju ugljikov
dioksid iz vode smanjuju njegovu koncentraciju samo u sloju vode
oko tkiva. Karakteristike tog sloja nemoguće je mjeriti. Posljednjih
godina, nakon niza eksperimenata i analiza snimaka precipitata kalcijeva
karbonata, potvrđeno je da i organizmi imaju utjecaja na taloženje
CaCO3 (Srdoč et al, 1985; Emeis et al.,
1987; Chafetz et al., 1991), a nisu samo supstrat.
|